Einleitung
Seit seiner Erstbeschreibung vor etwa 30 Jahren ist das Prostata-Spezifische-Antigen (PSA) untrennbar mit verschiedenen Erkrankungen der Prostata, allen voran dem Prostatakarzinom (PCA) verbunden. Um die Schwierigkeiten rund um Einsatz und Interpretation des PSA-Wertes zu Diagnostik und Therapie des PCA zu verstehen, muss man wissen, dass weit mehr Männer ein PCA haben (das heißt histologisch gemäß Autopsiestudien nachgewiesen: Prävalenz bei Männern ab dem 70. Lebensjahr etwa 50%) (1), als im Laufe ihres Lebens diagnostiziert werden (=in Biopsie eines asymptomatischen Mannes nachgewiesen), daran erkranken (=symptomatisch werden) oder daran versterben (=PCA-Mortalität, in Europa etwa 3%) (2). Das wahrscheinlich wichtigste Charakteristikum des PCA ist die hohe Variabilität seiner biologischen Aggressivität und daraus folgend dem individuell natürlichen Verlauf der Erkrankung. Manche Tumore entwickeln sich langsam und bergen für den betroffenen Mann die Gefahr einer „Überdiagnose“ und der folgenden „Überbehandlung“ mit allen therapiebedingten Nebenwirkungen. Im Unterschied zur überwiegenden Mehrzahl aller Malignome kann es daher beim PCA auch von Nachteil sein, einen Tumor nachzuweisen.
Bei der Bestimmung des PSA-Wertes sollten daher grundsätzlich folgende Annahmen berücksichtigt werden:
- Es geht bei der Bestimmung des PSA-Wertes nicht darum, möglichst viele oder gar alle PCA zu entdecken.
- Ziel des Einsatzes von PSA ist grundsätzlich die Früherkennung von auf die Prostata begrenzten, jedoch potentiell aggressiven Tumoren bei Männern mit einer Lebenserwartung von zumindest 10 Jahren.
1) Was ist PSA?
PSA wurde erstmals 1979 beschrieben und seit Ende der 80er Jahre urologisch-klinisch publiziert (3,4). PSA ist ein Glykoprotein, das in den Epithelzellen der Prostata gebildet wird und zur Verflüssigung des Seminalplasmas dient. Es liegt im Serum in freier (fPSA) und gebundener Form (tPSA) vor. Letzteres ist an alpha-1-Antichymotrypsin und alpha-2-Makroglobulin gebunden. Zusätzlich zur Bestimmung von tPSA, fPSA und deren Ratio ist die Messung von complexed PSA (cPSA=PSA an alpha-1-Antichymotripsin gebunden) möglich (5).
Klinische Bedeutung besitzen im urologischen Alltag vor allem das gesamt-PSA (tPSA), das in weiterer Folge PSA genannt wird und die Ratio von PSA zu fPSA (ratio) (6).
PSA wird in der Leber metabolisiert und hat eine Halbwertszeit von 48-72 Stunden. PSA ist ein organspezifischer, jedoch kein tumorspezifischer Marker. Es wird jedoch angenommen, dass das Leakage von PSA in die prostatische Blutzirkulation in Karzinomgewebe (oder etwa auch entzündetem Gewebe) 10-fach höher als in Normalgewebe oder BPH-Gewebe ist (benigne Prostatahyperplasie). Daher resultiert die mögliche Aussage von PSA in der Karzinomdiagnostik (5,6).
Weitere vom PSA abgeleitete Parameter sind die PSA-Density, welche das Gesamt-PSA in Verhältnis zum Prostatagesamtvolumen oder Prostata-Transitionalzonenvolumen (PSA-TZ-Density) angibt und die verschiedenen Methoden zur Darstellung der PSA-Kinetik, die PSA-Velocity (PSA-Anstieg über 1 Jahr) und die PSA-Doubling-Time (PSA-Verdoppelungszeit).
2) PSA-Bestimmung
PSA kann derzeit mit mehreren Dutzend kommerziell angebotenen Testkits bestimmt werden. Wenn auch grundsätzlich in der Aussage der verschiedenen Methoden keine wesentlichen Unterschiede bestehen, sollte bei einem gegebenen Patienten jedoch immer derselbe Test angewendet werden.
Einflüsse auf die PSA-Konzentration können neben dem Vorliegen eines PCA folgende Faktoren haben (6):
- Einnahme von (zumeist urologischen) Medikamenten (5alpha-Reduktasehemmer, Antiandrogene, LHRH-Analoga und –Antagonisten),
- Prostataerkrankungen (akute/chronische Prostatitis, gutartige Prostatahyperplasie, akute Harnverhaltung),
- Manipulationen (Biopsie, unmittelbare Ejakulation vor Abnahme, rektale Untersuchung, langes Fahrradfahren, Katheterisierung).
Zusätzlich zu bedenken ist bei der Interpretation des PSA-Wertes auch die biologische Variabilität, welche bei ca. 20% liegt und die analytische Variabilität, die mit etwa 5% angenommen werden darf (7). Aus diesem Grund wird heute von den meisten Fachleuten bei erstmaligem Vorliegen eines suspekt-erhöhten Wertes eine Kontrolle empfohlen.
Die altersentsprechenden „Referenzwerte“ liegen in der Größenordnung von 0.7 ng/ml bei Männern in den 40ern, um 0.9 ng/ml bei Männern in den 50ern, um 1.2 ng/ml ab dem 60. Lebensjahr und um 1.5 ng/ml ab 70 (8). In der Normalbevölkerung (Screening-Population ab 50. Lebensjahr) darf man als Orientierung für einen Normalwert annehmen, daß etwa 80-85% einen PSA<4 ng/ml, 10-15% PSA 4-10 ng/ml und 2-5% ein PSA >10 ng/ml haben (6).
Ein tatsächlicher „Normalwert“ existiert nicht, ein PSA-cut-off-Wert zwischen 3 und 4 ng/ml kann aber als Richtwert für eine Population zwischen 50 und 65 Jahren als plausibel angenommen werden und ist heutzutage im klinischen Alltag akzeptiert (9). Alternativ werden auch häufig die alterskorrigierten Werte von Osterling angewendet (10).
Grundsätzlich sollten folgende Annahmen gelten:
- Ein PSA-Normalwert existiert nicht
- Ein hoher PSA-Wert ist nicht sicher durch ein PCA bedingt.
- Auch Männer mit sehr niedrigen PSA-Werten können ein PCA haben.
- Je höher der PSA-Wert ist, desto größer ist, pauschal ausgedrückt, die Wahrscheinlichkeit, daß in einer Biopsie ein PCA entdeckt wird oder ein PCA vorliegt.
3) PSA und Screening
Als erste Maßnahme in der Kaskade des PSA-Einsatzes gilt das Screening, also der empfohlene, vom Untersucher initiierte Einsatz an einer unselektionierten Kohorte zum Zwecke der Reduktion der Mortalität und Morbidität des PCA. Screening durch PSA wurde bisher in der überwiegenden Mehrzahl von urologischen oder onkologischen Fachgesellschaften abgelehnt.
Grund hierfür waren im wesentlichen die sehr umstrittenen Daten der bisherigen Untersuchungen zur Evaluierung des PSA-screening-Nutzens, wie etwa der Tirol-screening-Studie (11). Im heurigen Jahr 2009 kamen zu dieser Frage die lange erwarteten Ergebnisse zweier großer Untersuchungen zur prominenten Publikation:
Die European Randomized Study of Screening for Prostate Cancer (ERSPC) umfaßt 182.000 Männer, die zu Studienanfang zwischen 50-74 Jahre alt waren. Diese Kohorte wurde 1:1 in einen PSA-screening- und einen ungescreenten Arm randomisiert. Nach einem follow-up von 9 Jahren gelangten nun alle Teilnehmer, die zu Studieneintritt 55-69 Jahre alt waren zur Analyse. Die kumulative PCA-Inzidenz lag bei 8.2% versus 4.8%, die PCA-Mortalitätsrate lag mit einem RR von 0.8 (95%CI 0.65-0.98) um 20% signifikant reduziert zugunsten der screening-Pupulation. Interessant ist noch die number needed to screen, welche hochrechnet, daß 1410 zum screening gehen müssen, um im Nachbeobachtungszeitraum bei 1 Mann einen PCA-bedingten Tod zu verhindern (12).
In der US-basierten Untersuchung „Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial“ wurden 76.700 Männer nach einer follow-up-Periode von 11 Jahren zur Auswertung gebracht. Es wurden im Screening-Arm um 22% mehr PCA gefunden (2820 versus 2322), ein signifikanter Unterschied in der PCA-Mortalität konnte jedoch nicht gezeigt werden. Die Hauptkritikpunkte an der US-Studie waren die 30%ige Kontaminationsrate an PSA-Bestimmungen in der Kohorte ohne PSA-screening und die Tatsache, daß 45% bereits vor Studieneintritt einen PSA-Wert bestimmen hatten lassen (13).
Derzeit ist es wahrscheinlich noch zu früh, um an der bisherigen Übereinkunft gegen eine Empfehlung zum PSA-screening etwas zu ändern. Im weiteren Beobachtungsverlauf könnte eine Senkung der Mortalität jedoch nachhaltig gezeigt werden und PSA müsste dann erneut einer eingehenden Diskussion bezüglich Nutzen und Risiko unterzogen werden.
4) PSA und Früherkennung
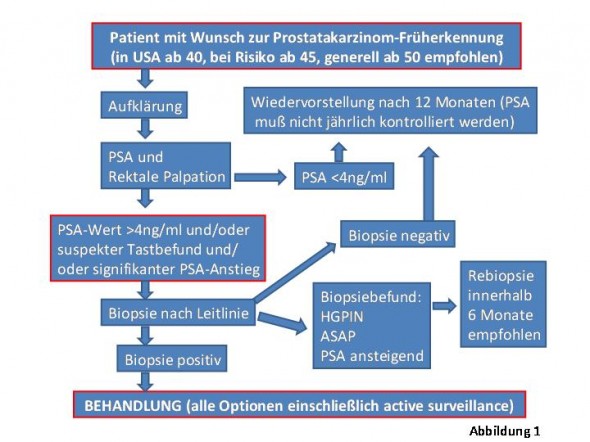
Im Unterschied zum Screening, geht bei der Prostatakarzinomfrüherkennung die Initiative vom Untersuchten aus und darf nach einer eingehenden Aufklärung über Vorteile und etwaige Risiken ab dem 50. Lebensjahr, bei erhöhtem Risiko (Verwandter I. Grades an PCA erkrankt) ab dem 45. Lebensjahr gemäß dem Algorithmus in Abbildung 1 angewendet werden (5).
Faktoren die zur Indikationsstellung für eine Prostatabiopsie beitragen sind neben einem kontrollierten, suspekten, erhöhten oder stark ansteigendem PSA-Wert, das Alter, die familiäre Belastung, die ethische Abstammung (cave andere Referenzwerte bei Afroamerikanern), das Ergebnis etwaiger vormaliger Biospien sowie die Kenntnis wesentlicher Komorbiditäten (6).
Ziel ist die Erkennung eines lokal begrenzten (auf die Prostata beschränkt), jedoch potentiell aggresiven Tumors, bei einer Lebenserwartung von zumindest 10 Jahren.
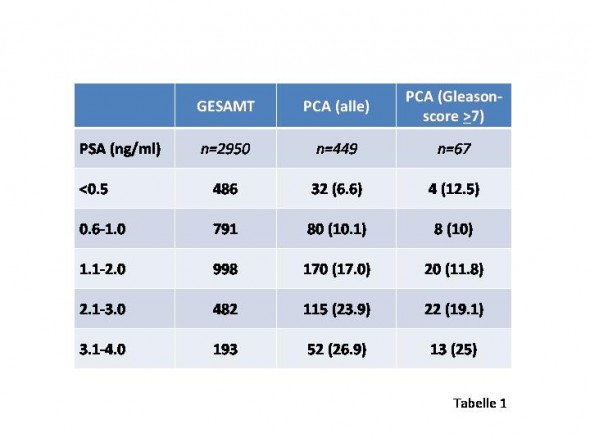
Der positive Vorhersagewert liegt nach Ausschluß von Störfaktoren zwischen 2-4 ng/ml bei etwa 15%, bei PSA 4-10 bei 25% und über 10 bei 35-50% (Tabelle 1) (14). Ein PSA über 4.0 ng/ml diagnostiziert kein PCA sondern stellt die Indikation zur Biopsie. Diese sollte gemäß der Guidelines durchgeführt werden. Jede PSA-Kontrolle muß gemeinsam mit einem rektalen Tastbefund durchgeführt werden. Wichtig zu erwähnen ist jedoch, daß die Palpation keine Früherkennungsmethode ist und nur 2-5% aller Tumore durch die Abtastung der Prostata bei „normalen“ PSA-Werten entdeckt werden. Die Wertigkeit zusätzlicher Verfahren (transrektaler Ultraschall (TRUS), MRI, fPSA, PSA-Density) ist, speziell in der Primärdiagnostik vor Erstbiopsie umstritten und sollte derzeit nicht empfohlen werden (5). Eine zusätzliche Information bietet, falls vorhanden die Kenntnis der PSA-Kinetik (=Verlauf der PSA-Werte über einen Beobachtungszeitraum).
5) PSA und Therapie / staging
Im Falle eines Tumornachweises durch eine Prostatabiopsie (zu 95% handelt es sich um Adenokarzinome) muß in Kenntnis der Gesamtsituation des betroffenen Mannes ein ausführliches Aufklärungsgespräch geführt werden, das in Übereinkunft zwischen Arzt und Patient das weitere Vorgehen festlegt. Hierbei geben folgende Parameter Aufschluß über den onkologischen Status des Tumors: Gleason-Score (histologisches grading-System, umso höher, umso schlechter differenziert=aggressiver), Anzahl und Lokalisation (Seite, apikal, basale Prostata) der betroffenen Biopsiezylinder, PSA, PSA-Kinetik und Rektalbefund. Bei PSA-Werten >20ng/ml sollten zusätzlich ein staging- Knochenszintigramm und ein CT oder MRI des Abdomens/Beckens durchgeführt werden (5).
Grundsätzlich ist es nicht notwendig, alle diagnostizierten PCAs auch tatsächlich einer aktiven Therapie zuzuführen. Neben den potentiell kurativen Therapieansätzen der Radikaloperation, der Brachytherapie (Jod125, Palladium103) oder der externen Bestrahlung sind im fortgeschrittenen Stadium noch die Hormontherapie (Antiandrogene, LHRH-Agonisten, -Antagonisten) und bei Tumoren mit potentiell geringem malignem Potential und/oder eingeschränkter Lebenserwartung die active survceillance möglich (15).
Der Stellenwert des PSA-Wertes liegt in der onkologischen Information:
Umso höher der PSA-Wert zur Biopsie ist, umso eher liegt ein Tumor vor, der ein hohes Volumen, eine extraprostatische (=organüberschreitend) Ausdehnung, einen höheren Gleason-Score (=potentiell aggressivere Differenzierung), eine Lymphknoten- oder ossäre Metastasierung oder ein höheres Risiko für ein Therapieversagen (Rezidiv) aufweist (16-18).
Der prädiktive Wert von PSA drückt sich auch in zahlreichen Nomogrammen aus, die zur Objektivierung der jeweiligen Wahrscheinlichkeiten für positive Lymphknoten, Organüberschreitung oder etwa ein rezidivfreies Überleben entwickelt wurden (19, 20).
Als Beispiel sei erwähnt, daß bei einem prätherapeutischen PSA-Wert von <4ng/ml die Wahrscheinlichkeit für einen organbeschränkten Tumor um 80%, bei einem PSA-Wert von 4-10 ng/ml um 70% und bei PSA > 10ng/ml um 50% liegt (21).
Analog verhält es sich mit dem (aufgrund der unterschiedlichen Methodik umstrittenen) Nachweis positiver Lymphknoten: Während bei einem PSA unter 10 ng/ml etwa 5% aller Männer positive Lymphknoten aufweisen, liegt die Rate bei Männern mit einem >20 ng/ml bereits um 35% (22).
Ähnlich darf auch eine Korrelation von PSA-Wert und Rezidivrisiko demonstriert werden: für jede Verdoppelung des PSA-Wertes steigt das Risiko für Rezidiv um etwa den Faktor 2 an (23).
6) PSA und follow-up
Unbestritten ist der Nutzen von PSA im follow-up von PCA-Patienten. Grundsätzlich ist hierbei je nach Primärtherapie zu unterscheiden.
Etwa 6 Wochen nach Radikaloperation wird eine Kontrolle des PSA-Wertes angestrebt und sollte im Idealfall unter der Nachweisbarkeitsgrenze liegen (<0.1 ng/ml). Weitere Kontrollen können ein Ansteigen des PSA feststellen, einRezidiv wird gemäß gering divergierender Leitlinien heute ab einem PSA-Wert größer 0.2 oder 0.4 ng/ml definiert (14).
Je nach Zeitpunkt und Kinetik des PSA-Anstieges in Zusammenschau mit der Primärhistologie kann die sonst sehr schwierige Unterscheidung zwischen einem Lokal- versus systemischen Rezidiv abgeschätzt werden (Tabelle 2). Dementsprechend wird dann mit dem Betroffenen das weitere Vorgehen bezüglich sekundärer Therapieformen (Bestrahlung versus Hormontherapie) besprochen.
Die Definition eines biochemischen Rezidives nach primärer Bestrahlung (extern versus Brachytherapie) erfolgt gemäß der ASTRO-Kriterien (American Society for Therapeutic Radiation and Oncology) und ist als zweimaliger, konsekutiver PSA-Anstieg über einen Nadir-Wert festgelegt (14).
Auch in der Prognose spielt PSA eine signifikante Rolle. So ist etwa die Höhe des PSA-Nadir nach 7 Monaten bei metastasierten Patienten, die einer primären Testosteronentzugstherapie unterzogen werden nicht unter 4 ng/ml ein schlechtes prognostisches Kriterium: es bedeutet ein medianes survival von einem Jahr, bei einem PSA-Nadir <0.2 ng/ml kann diese median um 6 Jahre liegen (24).
Ähnlich verhält es sich mit dem prognostischen Wert des PSA-Nadir beim biochemischen Rezidiv nach lokaler Primärtherapie: ein Nadir </> 0.2 ng/ml 8 Monaten nach sekundärer Hormontherapie war ein signifikanter Prädiktor für das mediane survival (25).
Im Unterschied dazu gilt derzeit das Ausmaß des PSA-Abfalls nach Chemotherapie nicht als ausreichend sicherer Parameter für das survival (6). Grundsätzlich muß bemerkt werden, daß PSA ein umstrittener surrogat-Parameter in der sekundären Therapie ist.
7) Zukunft des PSA-Einsatzes
Unter den vielen Bemühungen, unsere diagnostischen und therapeutischen Werkzeuge im Kampf gegen das PCA durch den Einsatz von PSA zu verbessern, erscheint aus Sicht der Autoren derzeit die Vorverlegung des Beginns der PSA-Bestimmung und die Beobachtung der PSA-Entwicklung in längeren Intervallen als sinnvoller Ansatz. Eine primäre PSA-Bestimmung ab dem 40. Lebensjahr mit einem Kontrollintervall von 2-4 Jahren könnte eine frühe Identifizierung von besonders aggressiven Tumoren, die erfahrungsgemäß oft junge Männer betreffen ermöglichen. Darüber hinaus wäre eine Beurteilung des PSA-Verlaufs (linear=eher BPH versus exponetiell=eher PCA) ein wichtiger zusätzlicher Parameter zur Unterscheidung maligner Prozesse von entzündlichen oder gutartig-proliferativen Erkrankungen. Darüber hinaus sollte der Einsatz von PSA bei betagten (>75a) oder komorbiden Patienten höchst kritisch gesehen werden.
Zusammenfassung
PSA ist mit Sicherheit der meistgenützte und meistdiskutierte Marker in der Urologie. Bedingt ist dieser breite Einsatz von PSA in der Hoffnung, Mortalität und Morbidität des Prostatakarzinoms zu senken, immerhin der häufigsten malignen nichtkutanen Erkrankung des älteren Mannes in westlichen Industrienationen.
Obwohl es aufgrund des oftmals sehr langen natürlichen Verlaufes bei Prostatakarzinomen sehr schwierig ist, den Nutzen von PSA oder grundsätzlich jeglicher medizinischer Maßnahme nachzuweisen, ist aus der Sicht der Autoren die Häufigkeit der PSA-Bestimmungen sehr wohl bedingt durch die vielfältigen Fragestellungen, wo uns PSA weiterhelfen kann.
In Zukunft wird PSA, so nicht ein potenterer Marker entwickelt und eingeführt wird weiter eine große Rolle spielen Es wird jedoch auf vielfältige Kenntnisse des behandelnden Arztes ankommen um karzinomrelevante Informationen jenseits eines einzelnen PSA-Wertes abzuleiten. Der Einsatz von PSA wird eventuell früher beginnen und früher enden (ab 40-75a) und nicht jeder entdeckte Tumor wird tatsächlich auch aktiv therapiert werden.
Literatur
- Yin M, Bastacky S, Chandran U et al: Prevalence of incidental prostate cancer in the general population: a study of healthy organ donors. J Urol 2008; 179: 892
- Ries LA, Melbert D, Krapcho M, et al. SEER Cancer Statistics Review, 1975-2005, National Cancer Institute. Bethesda, MD, http://seer.cancer.gov/csr/1975_2005/, based on November 2007 SEER data submission, posted to the SEER web site 2008
- Wang MC, Valenzuela LA, Murphy GP, Chu TM. Purification of a human PSA. Invest Urol 1979; 17: 159-63
- Stamey TA, Yang N, Hay AR, McNeal JE, Freiha FS, Redwine E. PSA as a serum marker for adenocarcinoma oft he prostate. N Engl J Med 1987; 317: 909-16
- PSA best practice statement 2009 update. Carroll P, Albertsen K, Greene G et al. AUA hompage 2009
- Börgermann C, Loertzer H, Luboldt HJ, Hammerer P, Fornara P, Graefen M, Rübben H.PSA – Quo vadis? Urologe A 2009; 98: 1008-14
- Sölétormos G, Semjonow A, Sibley PE, Lamerz R, Petersen PH, Albrecht W, Bialk P, Gion M, Junker F, Schmid HP, Van Poppel H. Biological variation of PSA. Clin Chem 2005; 51(8):1342-51
- Loeb, S., Roehl, K. A., Catalona, W. J. et al: Is the utility of prostate-specific antigen velocity for prostate cancer detection affected by age? BJU Int, 101: 817, 2008
- Cooner WH, Mosley BR, Rutherford CL et al. PC detection in a clinical urological practice by ultrasonography, digital rectal examination and PSA. J Urol 1990; 143: 1146-52
- Oesterling, JE, Jacobsen, S.J., Chute, C.G., et al: Serum prostate-specific antigen in a community-based population of healthy men. Establishment of age-specific reference ranges. JAMA, 270: 860, 1993
- Bartsch G, Horninger W, Klocker H, Pelzer A, Bektic J, Oberaigner W, Schennach H, Schäfer G, Frauscher F, Boniol M, Severi G, Robertson C, Boyle P; Tyrol Prostate Cancer Screening Project, early detection, treatment, outcome, incidence and mortality. Tyrol Prostate Cancer Screening Group. BJU Int 2008;101(7):809-16.
- Schroder, FH, Hugosson, J., Roobol, M.J., et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med, 360: 11320-8, 2009
- Andriole, G.L., Grubb, R.L., Buys, S.S., et al. Mortality results from a randomized prostatecancer screening trial. N Engl J Med, 360: 1310-19, 2009
- Thompson, I.M., Ankerst, D.P., Etzioni, R., Wang, T. It’s time to abandon an upper limit of normal for prostate specific antigen: assessing the risk of prostate cancer. J Urol. 4: 1219, 2008
- Heidenreich et al. EAU guidelines on Prostate Cancer 2009
- Loeb, S., Gonzalez, C.M., Roehl, K.A., et al: Pathological characteristics of prostate cancer detected through prostate specific antigen based screening. J Urol, 175: 902, 2006
- Catalona, W.J., Smith, D.S., and Ornstein, D.K.: Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/mL and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA, 277: 1452, 1997
- Partin, A.W., Kattan, M.W., Subong, E.N.P., et al: Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer: A multi-institutional update. JAMA, 277: 1445, 1997
- Kattan MW, Vickers AJ, Yu C. Preoperative and postoperative nomograms incorporating surgeon experience for clinically localized PC. Cancer 2009. 115: 1005-10
- Karakiewicz PI, Hutterer GC. Predicitve models and prostate cancer. Nat Clin Pract Urol 2008. 5: 82-92
- Rietbergen, J.B., Hoedemaeker, R.F., Kruger, A.E., et al: The changing pattern of prostate cancer at the time of diagnosis: characteristics of screen detected prostate cancer in a population based screening study. J Urol, 161: 1192, 1999
- Partin, A.W., Mangold, L.A., Lamm, D.M., et al: Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology, 58: 843, 200
- Freedland, S.J., Mangold, L.A., Walsh, P.C., et al: The prostatic specific antigen era is alive and well: prostatic specific antigen and biochemical progression following radical prostatectomy. J Urol, 174: 1276, 2005
- Hussain, M., Tangen, C.M., Higano, C., et al: Absolute prostate-specific antigen value after androgen deprivation is a strong independent predictor of survival in new metastatic prostate cancer: data from Southwest Oncology Group Trial 9346 (INT-0162). J Clin Oncol, 24: 3984, 2006
- Stewart, AJ, Scher, H.I., Chen, M.H., et al: Prostate-specific antigen nadir and cancer-specific mortality following hormonal therapy for prostate-specific antigen failure. J Clin Oncol, 23: 6556, 2005